客户论文精选 | 西北农林科技大学揭示限时进食改善阿尔茨海默病的肠道 - 脑轴机制
发布日期:2025-06-09 浏览次数:852
西北农林科技大学食品科学与工程学院刘志刚教授团队在国际期刊《iMeta》发表研究,首次系统揭示限时进食(TRF)通过调节肠道菌群 - 丙酸 - 游离脂肪酸受体 3(FFAR3)轴改善阿尔茨海默病(AD)认知功能的分子机制,并借助MadicLab PET/CT技术验证了代谢物跨血脑屏障的关键过程,为 AD 的非药物干预提供了新方向。

MadicLab PET/CT 在研究中的核心作用
在探索丙酸(PA)对 AD 的神经保护机制时,研究团队利用MadicLab Box 071系统进行正电子发射断层成像(PET),验证 PA 的脑内分布与代谢特性:
• PA 脑穿透能力验证:通过静脉注射[18F]标记的氟丙酸([18F]-FPA),PET 成像显示 PA 可穿透血脑屏障,在海马、皮层、纹状体等 AD 相关脑区显著富集。
• 代谢动态量化:PET 数据显示,AD 小鼠脑内 PA 代谢信号显著低于健康小鼠,而外源性 PA 补充可恢复这些区域的代谢活性,提示 AD 存在 PA 代谢障碍,补充 PA 可逆转这一异常。
• 机制关联性验证:结合 FFAR3 敲除实验,PET 成像证实 PA 的神经保护作用依赖 FFAR3 受体激活,为 “肠道菌群代谢物 - 脑轴” 机制提供了直接影像学证据。
研究背景与核心科学问题
阿尔茨海默病(AD)的全球患病率持续攀升,肠道菌群紊乱与 AD 病理的关联已被广泛关注,但 TRF 这种非侵入性饮食干预如何通过肠道-脑轴发挥神经保护作用尚不明确。本研究旨在解析 TRF 对 AD 的改善作用是否依赖肠道菌群及其代谢产物,并挖掘关键调控通路。
关键方法与突破性发现
1.临床干预:TRF 显著改善 AD 患者认知功能
•设计:9 例 AD 患者接受4 个月限时进食干预(每日 8 小时进食窗口),采用蒙特利尔认知评估量表(MoCA)评估认知变化。
•结果:患者整体认知评分显著提升(p<0.05),执行功能改善尤为显著;粪便丙酸(PA)水平与认知评分呈正相关(r=0.5677, p<0.0001),提示 PA 可能是 TRF 疗效的关键代谢标志物。
2.动物模型:TRF 通过肠道菌群缓解 AD 病理
•5xFAD 转基因小鼠模型:3 个月 TRF 干预显著缩短 Morris 水迷宫逃避潜伏期,减少脑内淀粉样蛋白(Aβ)沉积达 30%,并促进小胶质细胞向 Aβ 斑块聚集,降低炎症因子 TNF-α 和 IL-1β 表达。
•菌群清除实验:抗生素清除肠道菌群后,TRF 的认知改善作用完全消失,证实其依赖肠道菌群介导。补充长双歧杆菌(B. pseudolongum)可模拟 TRF 效果,显著降低 Aβ 沉积并提升 PA 水平。
3. 多组学解析:B. pseudolongum-PA-FFAR3 通路的核心作用
•微生物组与代谢组联合分析:TRF 显著富集B. pseudolongum,其丰度与 PA 水平正相关(r=0.68);PA 通过血脑屏障进入脑内,激活 FFAR3 受体,抑制 JNK 磷酸化并上调神经营养因子 BDNF。
•分子机制验证:FFAR3 基因敲除小鼠中,TRF 的神经保护作用完全消失,证实 FFAR3 是 TRF-PA 通路的关键靶点。
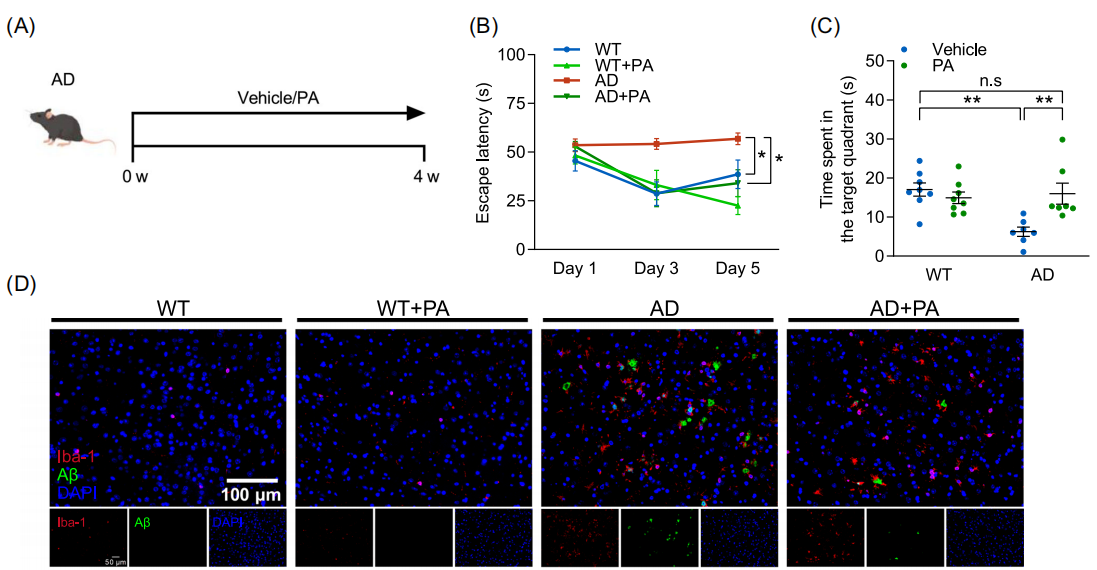
图:补充丙酸(PA)可改善 AD 小鼠的认知障碍。(A) 各组使用 PA 或载体处理的示意图(n=7-8)。(B) 逃避潜伏期。(C) 在目标象限停留的时间。(D) 小鼠皮层中 Aβ 沉积(绿色)和 Iba-1+(红色)小胶质细胞的免疫组织化学荧光图像(n=3)(比例尺,100 μm)
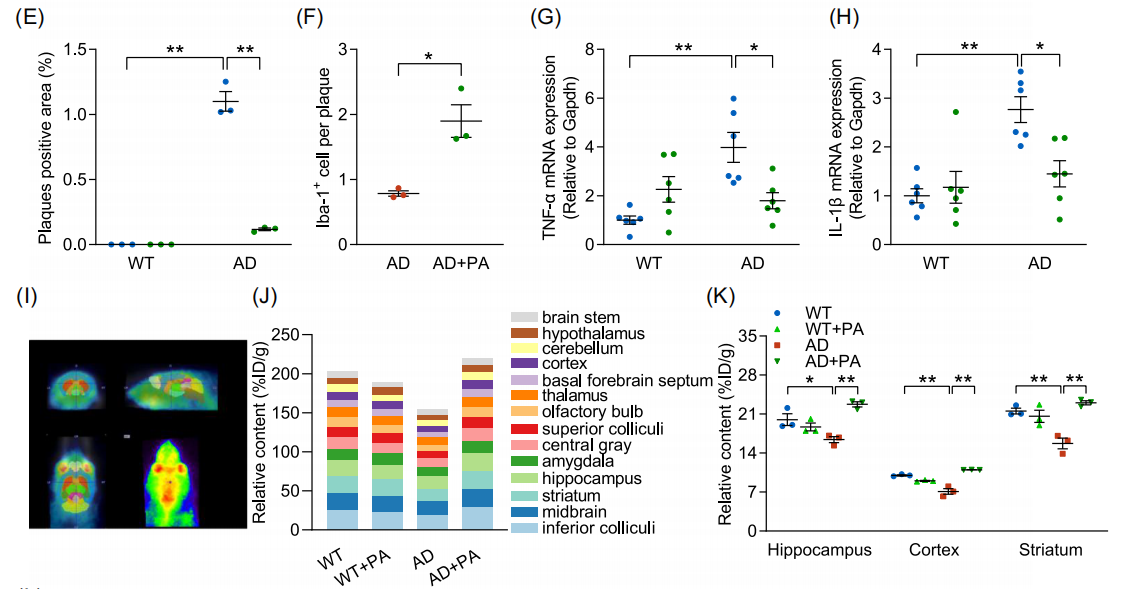
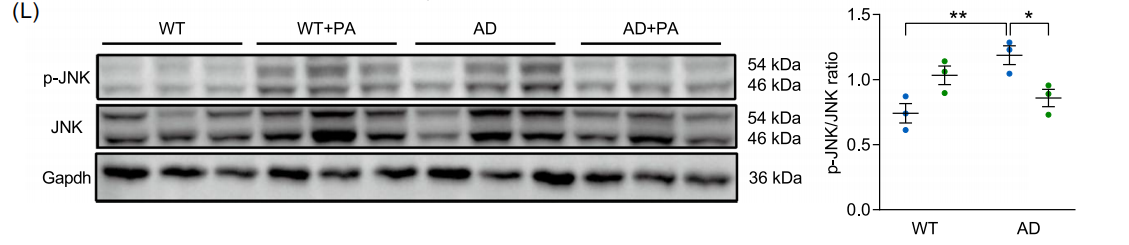
图:(E) 斑块阳性面积的定量分析。(F) Aβ 斑块相关小胶质细胞的定量分析。(G) TNF-α 的 mRNA 水平(n=6)。(H) IL-1β 的 mRNA 水平(n=6)。(I) 显示 PA 脑摄取的代表性轴位、矢状位和冠状位正电子发射断层扫描(PET)图像。(J) 脑中 [18F]-FPA 的摄取水平(% ID/g)(n=3)。(K) 海马、皮层和纹状体中 [18F]-FPA 的 PET 定量分析。(L) p-JNK 和 JNK 的蛋白质印迹分析(n=3)。数据以平均值 ± 标准误表示。*p<0.05,**p<0.01;采用双因素方差分析和 Tukey 多重比较检验。
转化潜力与临床意义
|
指标 |
TRF 干预的关键效应 |
|---|---|
|
肠道菌群 |
富集B. pseudolongum等有益菌,重塑菌群结构。 |
|
代谢产物 |
提升粪便丙酸(PA)水平,PA 与认知评分正相关,且可穿越血脑屏障调节神经炎症。 |
|
神经病理 |
减少 Aβ 沉积,抑制小胶质细胞过度活化,上调 BDNF 改善神经元存活。 |
|
非药物干预优势 |
相比传统药物,TRF 具有无创、易依从的特点,且可通过调节菌群 - 代谢轴实现多靶点干预。 |
潜在应用方向
•益生菌疗法:B. pseudolongum或可作为 AD 预防或辅助治疗的候选菌株,其产 PA 能力是关键特性。
•代谢物监测:粪便 PA 水平可作为 AD 早期诊断和 TRF 疗效评估的无创生物标志物,结合 MadicLab PET/CT 的脑成像技术可进一步提升机制研究的精准性。
•联合干预策略:结合 TRF 与 FFAR3 激动剂,可能增强神经保护效果,为 AD 个性化治疗提供新思路。
挑战与未来展望
•当前局限:临床样本量较小,需扩大队列验证 PA 作为生物标志物的普适性;长期 TRF 对肠道菌群的潜在影响仍需观察。
•研究方向:探索B. pseudolongum的最佳干预剂量、利用 MadicLab PET/CT 优化 PA 类似物的脑靶向递送效率,以及验证 TRF 在其他神经退行性疾病中的适用性。
论文链接: DOI: 10.1002/imt2.70006
设备支持:MadicLab Box 071系统(山东麦德盈华科技有限公司)
西北农林科技大学食品科学与工程学院刘志刚教授团队在国际期刊《iMeta》发表研究,首次系统揭示限时进食(TRF)通过调节肠道菌群 - 丙酸 - 游离脂肪酸受体 3(FFAR3)轴改善阿尔茨海默病(AD)认知功能的分子机制,并借助MadicLab PET/CT技术验证了代谢物跨血脑屏障的关键过程,为 AD 的非药物干预提供了新方向。

MadicLab PET/CT 在研究中的核心作用
在探索丙酸(PA)对 AD 的神经保护机制时,研究团队利用MadicLab Box 071系统进行正电子发射断层成像(PET),验证 PA 的脑内分布与代谢特性:
• PA 脑穿透能力验证:通过静脉注射[18F]标记的氟丙酸([18F]-FPA),PET 成像显示 PA 可穿透血脑屏障,在海马、皮层、纹状体等 AD 相关脑区显著富集。
• 代谢动态量化:PET 数据显示,AD 小鼠脑内 PA 代谢信号显著低于健康小鼠,而外源性 PA 补充可恢复这些区域的代谢活性,提示 AD 存在 PA 代谢障碍,补充 PA 可逆转这一异常。
• 机制关联性验证:结合 FFAR3 敲除实验,PET 成像证实 PA 的神经保护作用依赖 FFAR3 受体激活,为 “肠道菌群代谢物 - 脑轴” 机制提供了直接影像学证据。
研究背景与核心科学问题
阿尔茨海默病(AD)的全球患病率持续攀升,肠道菌群紊乱与 AD 病理的关联已被广泛关注,但 TRF 这种非侵入性饮食干预如何通过肠道-脑轴发挥神经保护作用尚不明确。本研究旨在解析 TRF 对 AD 的改善作用是否依赖肠道菌群及其代谢产物,并挖掘关键调控通路。
关键方法与突破性发现
1.临床干预:TRF 显著改善 AD 患者认知功能
•设计:9 例 AD 患者接受4 个月限时进食干预(每日 8 小时进食窗口),采用蒙特利尔认知评估量表(MoCA)评估认知变化。
•结果:患者整体认知评分显著提升(p<0.05),执行功能改善尤为显著;粪便丙酸(PA)水平与认知评分呈正相关(r=0.5677, p<0.0001),提示 PA 可能是 TRF 疗效的关键代谢标志物。
2.动物模型:TRF 通过肠道菌群缓解 AD 病理
•5xFAD 转基因小鼠模型:3 个月 TRF 干预显著缩短 Morris 水迷宫逃避潜伏期,减少脑内淀粉样蛋白(Aβ)沉积达 30%,并促进小胶质细胞向 Aβ 斑块聚集,降低炎症因子 TNF-α 和 IL-1β 表达。
•菌群清除实验:抗生素清除肠道菌群后,TRF 的认知改善作用完全消失,证实其依赖肠道菌群介导。补充长双歧杆菌(B. pseudolongum)可模拟 TRF 效果,显著降低 Aβ 沉积并提升 PA 水平。
3. 多组学解析:B. pseudolongum-PA-FFAR3 通路的核心作用
•微生物组与代谢组联合分析:TRF 显著富集B. pseudolongum,其丰度与 PA 水平正相关(r=0.68);PA 通过血脑屏障进入脑内,激活 FFAR3 受体,抑制 JNK 磷酸化并上调神经营养因子 BDNF。
•分子机制验证:FFAR3 基因敲除小鼠中,TRF 的神经保护作用完全消失,证实 FFAR3 是 TRF-PA 通路的关键靶点。

图:补充丙酸(PA)可改善 AD 小鼠的认知障碍。(A) 各组使用 PA 或载体处理的示意图(n=7-8)。(B) 逃避潜伏期。(C) 在目标象限停留的时间。(D) 小鼠皮层中 Aβ 沉积(绿色)和 Iba-1+(红色)小胶质细胞的免疫组织化学荧光图像(n=3)(比例尺,100 μm)


图:(E) 斑块阳性面积的定量分析。(F) Aβ 斑块相关小胶质细胞的定量分析。(G) TNF-α 的 mRNA 水平(n=6)。(H) IL-1β 的 mRNA 水平(n=6)。(I) 显示 PA 脑摄取的代表性轴位、矢状位和冠状位正电子发射断层扫描(PET)图像。(J) 脑中 [18F]-FPA 的摄取水平(% ID/g)(n=3)。(K) 海马、皮层和纹状体中 [18F]-FPA 的 PET 定量分析。(L) p-JNK 和 JNK 的蛋白质印迹分析(n=3)。数据以平均值 ± 标准误表示。*p<0.05,**p<0.01;采用双因素方差分析和 Tukey 多重比较检验。
转化潜力与临床意义
|
指标 |
TRF 干预的关键效应 |
|---|---|
|
肠道菌群 |
富集B. pseudolongum等有益菌,重塑菌群结构。 |
|
代谢产物 |
提升粪便丙酸(PA)水平,PA 与认知评分正相关,且可穿越血脑屏障调节神经炎症。 |
|
神经病理 |
减少 Aβ 沉积,抑制小胶质细胞过度活化,上调 BDNF 改善神经元存活。 |
|
非药物干预优势 |
相比传统药物,TRF 具有无创、易依从的特点,且可通过调节菌群 - 代谢轴实现多靶点干预。 |









